4 実験2
4.1 実験の準備
4.1.1 材料
プラナリアは動物分類学上、扁形動物門、渦虫綱の総称であり、本実験にはナミウズムシ(Dugesia japonica)を用いた。ナミウズムシは、体長20~25mm、茶褐色~黒褐色、頭部は三角形をしており、北海道を除く日本列島全域に分布している11)。 また、プラナリアは移動性の少ない、好冷水性、好清水性の動物であり、生息分布の変動や異常再生などにより、環境汚染の指標として利用されている27)。
本実験に用いた個体は、勢多郡富士見村箕輪、赤城白川、標高1000mで採集した個体で、15ヶ月間飼育し、20℃の飼育条件に慣らしたものである。個体は狭い範囲で採取したものかつ長期間飼育したもので、遺伝的にはほぼ均一であるといえる。
4.1.2 飼育用のエサ
イトミミズ(生き餌):ペットショップより購入。
4.1.3 飼育水
飼育水には対照水1種類と実験水5種類を用いた。飼育水は、ガラス製メスフラスコ、ガラス製細口試薬ビンに入れ、低温定温器中20℃で保存した。飼育水は2週間ごとに新しく作りかえた。実験に用いた飼育水をTable.8に示す。
Table.8 実験に用いた飼育水
| 飼育水 | 記号 | 溶質名(水溶液) | 溶質濃度(ppb) | 備考 |
| 対照水2 | CE | エタノール | 1.00×103 |
|
| 実験水 | M1 | スチレン | 1.03 | エタノール1.00×103ppb |
| 実験水 | M2 | スチレン | 1.03×10-2 | エタノール1.00×10ppb |
| 実験水 | A1 | ビスフェノールA | 2.00×103 |
|
| 実験水 | A2 | ビスフェノールA | 5.0 |
|
| 実験水 | A3 | ビスフェノールA | 5.0×10-2 |
|
4.1.4 対照水2の調整
水道水1000?をガラス製1?ビーカーに入れ、5分間沸騰させ、20℃まで冷却したものを対照水(C)とした。エタノール1?に対照水(C)を加え1000?とし、そのエタノール水溶液1?に対照水(C)を加え1000?としたものを対照水2(CE)とした。対照水2(CE)はエタノール水溶液でエタノール濃度は1000ppbである。この濃度は、スチレン実験水1(M1)に含まれるエタノール濃度と同じ値である。
4.1.5 実験水の調整
4.1.5.1 調整のルール
・実験水は対照水(C)を用いて調製した。
・原液は調製に用いたガラス製メスフラスコ中に入れたまま、約2~3℃で保管した。 また、保存中の水の蒸発を防ぐ目的で栓周囲をパラフィルムで覆った。
4.1.5.2 スチレン実験水の調整
スチレンはベンゼン環にビニル基が付加した構造(Fig.10)をもち、融点-30.69℃、沸点145.2℃、比重d420=0.9090の無色透明の液体で芳香をもっている。実験に使用したスチレンは東京化成工業(株)東京化成特級(ガスクロマトグラフ法により99.0%以上)を用いた。
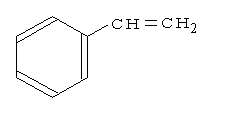 Fig.10 スチレンの構造式
Fig.10 スチレンの構造式
ポリスチレンは、一般に、エチレン(エチレンモノマー)とベンゼンからエチルベンゼンを介して得られたスチレン(スチレンモノマー)を重合させたポリマー(プラスチック)である。したがって、製品にはこれら揮発性原料などが残留している可能性があり、食品衛生法に基づく規格基準では材質中の揮発性物質の規制をおこなっている。熱水を用いる発砲ポリスチレンは残留物の濃度が2000ppm以下かつスチレン及びエチルベンゼンの濃度がそれぞれ1000ppm以下と定められている。しかし、カップラーメン容器は、メーカーがそれよりも厳しい自主規制をおこなっているという25)。このため残留物濃度、熱水への溶出濃度にもかなりのばらつきがある。
・ポリスチレン製カップラーメン容器29品について室温の水を入れ30分放置後で 不検出(検出限界10ppb)~120ppb20)のスチレンモノマーが溶出した。
・食品用ポリスチレン製容器214品に熱水を入れ30分放置後で最高44ppb21)のスチレン モノマーが溶出した。
・カップラーメン容器に沸騰水200mlを加え、アルミはくでふたをし、 5分後で1~33ppb22)のスチレンモノマーが溶出した。
そこで、実験水の濃度設定はスチレン溶出報告の最小値を参考に、実験水M1のスチレン濃度を1.0ppbに設定した。また、検出限界を考慮し実験水M2は0.010ppbに設定した。
(1)~(5)はスチレン実験水の調整方法である。また、Fig.11はスチレン実験水の調製手順をモデル化したものである。
(1)スチレン 0.5132 gを500? のエタノール溶液にした。
濃度計算:0.5132/500=1.0264/103=1026.4/106=1026.4ppm →原液①
エタノール濃度:100%
(2)原液①10?を1000?の水溶液にした。
濃度計算:1.0264/106×10/1000=10.264/106 =10.264ppm →原液②
エタノール濃度:1/100=1%
(3)原液②10?を1000?の水溶液にした。
濃度計算:10.264/106 ×10/1000=0.10246/106 =0.10246ppm →原液③
エタノール濃度:1/104 =100 ppm
(4)原液③10?を1000?の水溶液にした。
濃度計算:0.10246/106×10/1000=1.0264/109=1.0246 ppb →(M1)
エタノール濃度:1/106 =1ppm
(5)スチレン実験水(M1)10?を1000?の水溶液にした。
濃度計算:1.0264/109 ×10/1000=0.010246 ppb→(M2)
エタノール濃度:1/108 =10 ppb
スチレン実験水には(M1)、(M2)を用いた。
4.1.5.3 ビスフェノールA実験水の調製
ビスフェノールAはフェノール基をふたつもった構造(Fig.12)で、フェノールとアセトンから合成される。主にポリカーボネート樹脂、エポキシ樹脂、フェノール樹脂、殺菌剤、ゴム酸化防止剤の原料、塩化ビニールの安定剤、歯科材料の合成原料などに用いられ、乳ガン細胞を増殖させる、マウスの精子を減少させるなどの環境ホルモン作用が報告されている2)~5)。実験にはキシダ化学(株)1級(融点154~157℃)を使用した。
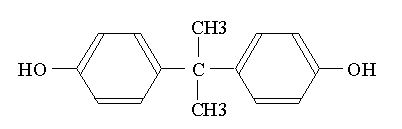
Fig.12 ビスフェノールAの構造式
実験水の濃度は、以下の理由から設定した。食品衛生法で定めたビスフェノールAの基準値2500ppbを参考にして、実験水A1の濃度を基準値上限付近2000ppbとした。日本子孫基金が横浜国立大学環境科学研究センターに依頼しておこなった、ポリカーボネート製哺乳瓶からのビスフェノールA溶出検査では、水95℃における溶出量3.1~5.5ppbであった2)。これを参考にして、実験水A2の濃度を検出値上限付近5.00 ppbとした。環境庁がおこなった1996年度化学物質環境安全性総点検調査での検出地の検出値が水質0.010~0.268ppb、魚類0.015~0.287ppbであった26)。これを参考にして、実験水A3の濃度を検出値下限付近0.0500 ppbとした。
(1)~(5)はビスフェノールA実験水の調整方法である。また、Fig.13はビスフェノールA実験水の調製手順をモデル化したものである。
(1)ビスフェノールA 0.0100gを1000?の水溶液にした。
濃度計算:0.0100/103 =10/106=10.0ppm →原液①
(2)原液①10?を 1000?の水溶液にした。
濃度計算:10/106×10/1000=100/109 =100 ppb →原液②
(3)原液①200?を1000?の水溶液にした。 濃度計算:10/106× 200/1000=2000/109 =2000 ppb →(A1)
(4)原液②50?を1000?の水溶液にした。
濃度計算:100/109× 50/1000=5.00 ppb →(A2)
(5)実験水(A2)10?を1000?の水溶液にした。
濃度は 5/109× 10/1000=0.0500 ppb →(A3)
ビスフェノールA実験水には(A1)、(A2)、(A3)を用いた。
4.1.6 調製誤差の検討
実験水の調製では多段階の希釈をおこなった。この結果、実験器具の精度を超えた誤差が生じると考えらる。このため、濃度がどの程度まで確かなのかを検証した。器具の誤差は、電子天秤は仕様書を参考にし、ホールピペット50ml、100mlの許容誤差はJIS R3505-1994クラスAとし、他のガラス体積計はJIS R3505-1994クラスBの許容誤差内にあるものとした。はかりとった質量、体積を秤量値とし、それに器具精度を加えたものを最大値、引いたものを最小値とした。濃度計算においては、秤量値から計算した値を調整値とし、常に濃度最大となる方向に誤差が生じた場合の値を最大値とし、常に濃度最小となる方向に誤差が生じた場合の値を最小値とした。また、調整値を真の値と仮定し、最大値または最小値から調整値を引いた値を誤差とし、誤差と最大値、最小値の比を誤差率とした。
Table.9は、実験水の調製に用いた器具である。Table.10はスチレン実験水の誤差検証の過程である。スチレン実験水においてはM1、M2ともに2%程度の誤差率であった。検証の結果、有効数字2桁までは保証でき、3桁目に誤差を含む。そこでM1の濃度を
1.03ppb、M2の濃度を0.0103ppbとする。
Table.11はビスフェノールA実験水の誤差検証の過程である。ビスフェノールA実験水においてはA1は2%程度の誤差率で、有効数字2桁までは保証でき、3桁目に誤差を含む。A2、A3はともに3%程度の誤差率で、有効数字1桁までは保証でき、2桁目に誤差を含む。そこでA1の濃度を2.00×103ppb、A2の濃度を5.0ppb、A3の濃度を0.050ppbとする。
Table.9 実験水の調製にもちいた器具の精度
| 質量・体積測定器具 | 精度 | 最小(g) |
|
| AG245(Mettler-Toledo GmbH) | ±0.0002(g) | 0.0001 |
| ホールピペット 1ml | 0.02(ml) |
|
| ホールピペット 10ml | 0.04(ml) |
| ホールピペット 50ml | 0.05(ml) |
| ホールピペット 100ml | 0.08(ml) |
| メスフラスコ 500ml | 0.5 (ml) |
| メスフラスコ 1000ml | 0.8 (ml) |
Table.10 スチレン実験水調製過程における誤差の検証
Table.11 ビスフェノールA実験水調製過程における誤差の検証
4.1.7 飼育・観察・記録の方法
(1)飼育方法
①プラナリアには有性生殖と無性生殖がある。プラナリアの生活史は水温に強く支配されており夏期に低温下(5~10℃)で飼育すると、有性系個体では生殖器官が退化せず、無性系個体では分裂しなくなる。また、冬季でも高温(20~25℃)のもとで飼育すると、生殖器官が退化して有性系の虫でも横分裂するようになる10)。そこで、プラナリアを分裂によって増やすため20℃で飼育することとした。また、飼育容器には直径8cmのガラス製シャーレを用いた。
②週2回(月・木曜日)エサを与える。エサの量は、プラナリア1匹に対し、イトミミズ2~3匹程度とする。
③エサを与えた翌日(火・金曜日)に、飼育容器の掃除、飼育水の取り替えを行う。 (2)観察・記録方法
①観察は毎日行い、別紙記録用紙に記録する。
②観察・記録項目
ⅰ 観察年月日および飼育開始からの経過日数
ⅱ 低温定温器の温度
ⅲ 各飼育容器中のプラナリアの個体数
ⅳ 各プラナリアの状態
4.2 実験の方法
4.2.1 対照実験区2(記号CE)
6つのガラス製シャーレにエタノールを溶かした対照水2(CE)(30?)とプラナリア1匹を入れ分裂による個体数の変化を記録した。

Fig.14 対照実験区2(CE-1~CE-6)
4.2.2 スチレン実験区1 (記号M1)
6つのガラスシャーレにスチレンを溶かした実験水M1(30?)とプラナリア1匹を入れ分裂による個体数の変化を記録した。

Fig.15 スチレン実験区1(M1-1M1-6)
4.2.3 スチレン実験区2 (記号M2)
6つのガラスシャーレにスチレンを溶かした実験水M2(30?)とプラナリア1匹を入れ分裂による個体数の変化を記録した。

Fig.16 スチレン実験区2(M2-1~M2-6)
4.2.4 ビスフェノールA実験区1 (記号A1)
6つのガラスシャーレにビスフェノールAを溶かした実験水A1(30?)とプラナリア1匹を入れ分裂による個体数の変化を記録した。

Fig.17 ビスフェノールA実験区1(A1-1~A1-6)
4.2.5 ビスフェノールA実験区2 (記号A2)
6つのガラスシャーレにビスフェノールAを溶かした実験水A2(30?)とプラナリア1匹を入れ分裂による個体数の変化を記録した。

Fig.18 ビスフェノールA実験区2(A2-1~A2-6)
4.2.6 ビスフェノールA実験区3 (記号A3)
6つのガラスシャーレにビスフェノールAを溶かした実験水A3(30?)とプラナリア1匹を入れ分裂による個体数の変化を記録した。

Fig.19 ビスフェノールA実験区3(A3-1~A3-6)
注)2000年5月5日~2000年7月20日までの76日間観察した。
観察期間中の水温は、平均値20.0℃、最大値20.2℃、最小値19.8℃であった。








