3 実験1(1999年度に行い、発表した実験である。)
3.1 実験の準備
3.1.1 材料
プラナリアは動物分類学上、扁形動物門、渦虫綱の総称であり、本実験にはナミウズムシ(Dugesia japonica)を用いた。ナミウズムシは、体長20~25mm、茶褐色~黒褐色、頭部は三角形をしており、北海道を除く日本列島全域に分布している11)。 また、プラナリアは移動性の少ない、好冷水性、好清水性の動物であり、生息分布の変動や異常再生などにより、環境汚染の指標として利用されている27)。
本実験に用いた個体は、勢多郡富士見村箕輪、赤城白川、標高1000mで採集した個体で、2ヶ月間飼育し、20℃の飼育条件に慣らしたものである。個体は狭い範囲で採取したもので、遺伝的にはほぼ均一であるといえる。
3.1.2 飼育用のエサ
イトミミズ(生き餌):ペットショップより購入。
3.1.3 ポリスチレン製容器
ポリスチレンは、一般に、エチレンモノマーとベンゼンからエチルベンゼンを介して得られたスチレンモノマーを重合させたポリマー(プラスチック)である。したがって、製品にはこれら揮発性原料などが残留している可能性がある。そこで、食品衛生法に基づく規格基準では材質中の揮発性物質の規制をおこなっている。熱水を用いる発砲ポリスチレンは残留物の濃度が2000ppm以下かつスチレン及びエチルベンゼンの濃度がそれぞれ1000 ppm以下と定められている。しかし、カップラーメン容器は、メーカーがそれよりも厳しい自主規制をおこなっている25)。また、ポリスチレン製カップラーメン容器から熱水への スチレンモノマー溶出についての知見が多くの研究機関から報告されている。以上の理由から、ポリスチレン製容器としてカップラーメン容器を実験に用いた。
カップラーメン容器にはポリエチレンでコーティングされた紙製とポリスチレン製があるが、実験にはポリスチレン製の容器を使用した。また、カップラーメン容器に付着する油分等の影響を除くため、スープ別包装のノンフライ麺のカップラーメン容器(未使用)を使用した。
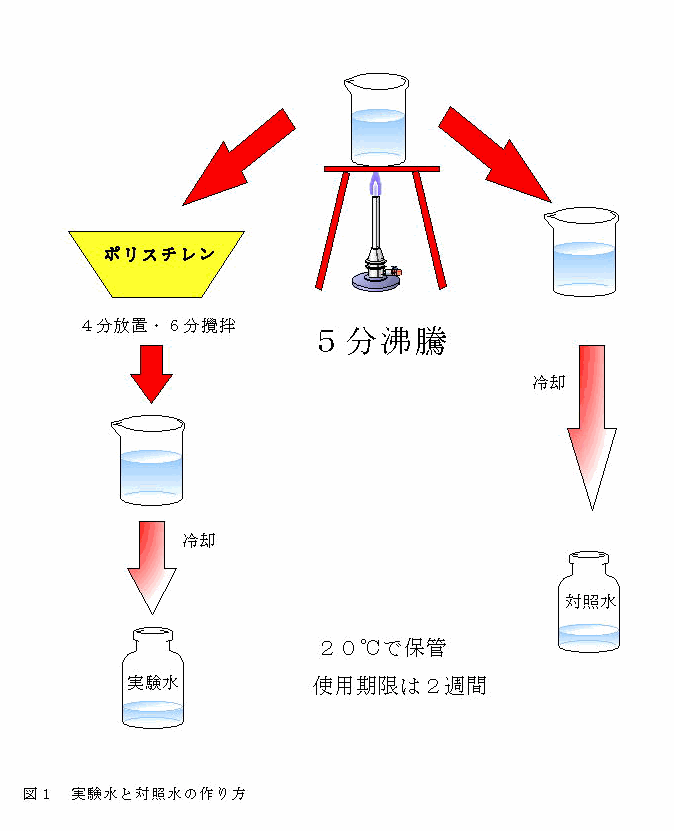
3.1.4 飼育水 (対照水と実験水)
飼育水には対照水と実験水の二種類を用いた。対照水は500?を1?ビーカーに入れ、5分間沸騰させ、冷却後500?ガラス製細口試薬ビンに入れ、低温定温器中で 20℃で保存した。
実験水は水道水500?を5分間沸騰させた後カップラーメン容器(ポリスチレン製容器)に注ぎ、ふたをして4分間放置した後6分間かき混ぜ、ビーカーに移し換えて冷却した。実験水も対照水と同様に保存した。飼育水は2週間ごとに新しく作り変えた。
Fig.1は飼育水の作り方である。
3.1.5 飼育・観察・記録の方法
(1)飼育方法
①プラナリアには有性生殖と無性生殖がある。プラナリアの生活史は水温に強く 支配されており夏期に低温下(5~10℃)で飼育すると、有性系個体では生殖 器官が退化せず、無性系個体では分裂しなくなる。また、冬季でも高温(20~ 25℃)のもとで飼育すると、生殖器官が退化して有性系の虫でも横分裂するよ うになる10)。そこで、プラナリアを分裂によって増やすため20℃で飼育するこ ととした。また、飼育容器には直径8cmのガラス製シャーレ(対照区、実験区) とポリスチレン製のカップラーメン容器を用いた。
②週2回(月・木曜日)エサを与える。エサの量は、プラナリア1匹に対し、イ トミミズ2~3匹程度とする。
③エサを与えた翌日(火・金曜日)に、飼育容器の掃除、飼育水の取り替えを行う。(2)観察・記録方法
①観察は毎日行い、別紙記録用紙に記録する。
②観察・記録項目
ⅰ 観察年月日および飼育開始からの経過日数
ⅱ 低温定温器の温度
ⅲ 各飼育容器中のプラナリアの個体数
ⅳ 各プラナリアの状態
3.2 実験の方法
3.2.1 対照区 (記号C)
6つのガラス製シャーレに対照水40mlとプラナリア1匹を入れ分裂による個体数の変化を記録した。





Fig.2 対照区(C-1~C-6)
3.2.2 実験区 (記号E)
6つのガラス製シャーレに実験水40mlとプラナリア1匹を入れ分裂による個体数の変化を記録した。






Fig.3 実験区(E-1~E-6)
3.2.3 ポリスチレン製容器中で飼育した実験区(記号S)
6つのポリスチレン製容器(カップラーメン容器)に実験水40mlプラナリア1匹を入れ分裂による個体数の変化を記録した。






Fig.4 ポリスチレン製容器中で飼育した実験区(S-1~S-6)
注)C-1~C-3,E-1~E-3,S-1~S-3は1999年4月1日~1999年5月 30日までの59日間観察した。C-4~C-6,E-4~E-6,S-4~S-6 は1999年6月5日~1999年8月3日までの59日間観察した。
3.3 結果及び考察
Table.1は各実験区の個体数変化を示したものである。対照区においては、順調に分裂が進み59日後の平均個体数は3.8匹、1回の分裂に要した平均日数は15.4日となった。この結果は、参考文献10のプラナリアの分裂日数15.9日とよく一致した。実験区においては、59日後の平均個体数は2.0匹となり分裂に要した平均日数は29.5日となった。
なお、1999.4.1~1999.5.30の観察期間中の水温については、平均値20.1℃、最大値22.4℃、最小値18.6℃であった。また、1999.6.5~1999.8.3の観察期間中の水温は、平均値
21.0℃、最大値26.0℃、最小値15.0℃であった。
Table.1 対照区と実験区の59日後のプラナリアの個体数
| 個体NO. | 対照区(匹) | 実験区(匹) |
| 1 | 5 | 3 |
| 2 | 3 | 3 |
| 3 | 4 | 1 |
| 4 | 5 | 1 |
| 5 | 3 | 3 |
| 6 | 3 | 1 |
| 平均 | 3.83 | 2.00 |
Fig.5は各実験区におけるプラナリア個体数の平均値と経過日数の関係をグラフにしたものである。一般的に生物の個体数が増加する初期段階では、指数的に増加することが知られているので12) それぞれの実験区のデータをもとに指数回帰曲線をもとめた。対照区ではy=e0.0265x (ただしyは個体数、xは経過日数)となった。一方、実験区ではy=e0.0137x となった。このグラフから、明らかに対照区と実験区の個体数増加には差があると思われる。そこで59日後のプラナリアの個体数(Table.1)をもとにt検定を行った。
t検定とはt分布を使って、2つの標本の母平均(母集団の平均)が等しいか等しくないかを確認する手法で、2グループ(標本数m、n)の分散が等しいときt値(平均の差を表す統計量)が自由度m+n-2のt分布に従うことを利用して検定する。一般的に、統計では標本数をある程度大きくして正規分布を利用するという、大標本理論に基づく計算がおこなわれる。しかし、個体や飼育条件の違いをなくし、同一条件での標本データを大量に収集することが困難である場合は、小標本理論に基づく計算がおこなわれる
13,14)。Excelの分析ツールに用意されているt検定は、きわめて少ない標本でも2つの標本が、平均値の等しい母集団から取り出されたものであるかどうかを確率的に予測できる15)~17)。そこで、t検定には表計算ソフトのExcel(Microsoft)をもちいた。
有意水準αを小さくしすぎると「帰無仮説が誤りであるのに受容してしまう確率」すなわち「第2種の誤り」を犯す確率を大きくしてしまう。このため、有意水準αは通例
0.05(信頼度95%)に設定される
18)。このような理由でここではF検定、t検定ともに有意水準αは0.05に設定した。
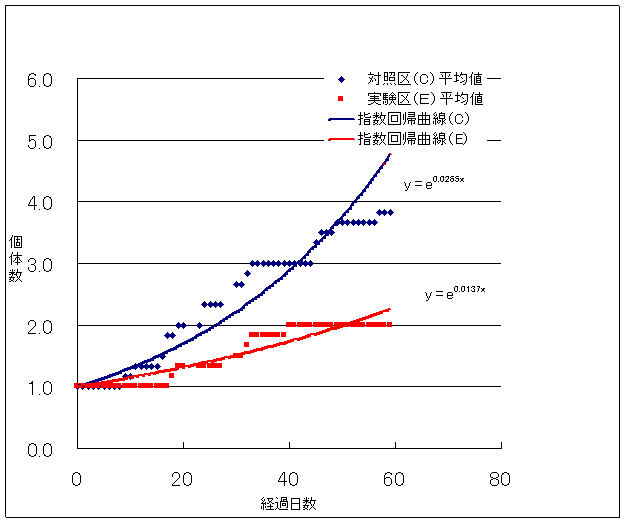
Fig.5 プラナリア個体数(平均値)の変化
t検定おこなうには事前にF検定をおこない等分散性の検定が必要となる。そこで、
帰無仮説:対照区の母分散と実験区の母分散は等しい
対立仮説:対照区の母分散と実験区の母分散は等しくない
として、ExcelでF検定をおこなった。Table.2はその結果である。
Table.2 実験区と対照区のF検定の結果(Excel)
| F検定: 2標本を使った分散の検定 |
| | 実験区 | 対照区 |
| 平均(匹) | 2.000 | 3.833 |
| 分散 | 1.200 | 0.967 |
| 観測数 | 6 | 6 |
| 自由度 | 5 | 5 |
| 観測された分散比 | 1.241 | |
| P(F<=f) 両側 | 0.409 | |
| F 境界値 両側 | 5.050 | |
Table.2では、観測された分散比1.241はF境界値両側5.050以内なので、帰無仮説は受容される。よって、信頼度95%で、等分散である。
つぎに、Excelでt検定(等分散を仮定した2標本による検定)をおこなった。t検定では、仮説平均との差異を0、有意水準αを0.05として、両側検定をおこなった。仮説平均との差異0と設定したので、
帰無仮説:対照区の母平均と実験区の母平均は等しい
対立仮説:対照区の母平均と実験区の母平均は等しくない
として、t検定をおこなった。Table.3はt検定の結果である。
Table.3 対照区と実験区のt検定の結果(Excel)
| t検定: 等分散を仮定した2標本による検定 |
| | 対照区 | 実験区 |
| 平均(匹) | 3.833 | 2.000 |
| 分散 | 0.967 | 1.200 |
| 観測数 | 6 | 6 |
| プールされた分散 | 1.083 | |
| 仮説平均との差異 | 0.000 | |
| 自由度 | 10 | |
| t | 3.051 | |
| P(T<=t) 片側 | 0.006 | |
| t 境界値 片側 | 1.812 | |
| P(T<=t) 両側 | 0.012 | |
| t 境界値 両側 | 2.228 | |
t値がt境界値両側以上ならば、帰無仮説は棄却される18)。t値3.051はt境界値両側
2.228以上なので、帰無仮説は棄却され信頼度95%で2つの標本の母平均には有意な差があるといえる。
以上の結果から、対照区と実験区の個体数の増加、つまり分裂頻度には差があるといえる。
つぎに、ポリスチレン製容器中で飼育した実験区について同様の検定をおこなってみた。
Table.4はポリスチレン製容器中で飼育した実験区と対照区の59日後のプラナリアの個体数である。
Table.4 ポリスチレン製容器中で飼育した実験区と対照区の59日後のプラナリアの個体数
個体NO.
|
対照区(匹)
|
ポリスチレン製容器中で
飼育した実験区(匹) |
| 1 | 5 | 1 |
| 2 | 3 | 2 |
| 3 | 4 | 5 |
| 4 | 5 | 5 |
| 5 | 3 | 2 |
| 6 | 3 | 4 |
| 平均 | 3.83 | 3.17 |
t検定をおこなうには事前にF検定をおこない等分散性の検定が必要となる。そこで、
帰無仮説:対照区の母分散と実験区の母分散は等しい
対立仮説:対照区の母分散と実験区の母分散は等しくない
として、ExcelでF検定をおこなった。Table.5はその結果である。
Table.5 ポリスチレン製容器中で飼育した実験区と対照区のF検定の結果(Excel)
| F検定: 2標本を使った分散の検定 |
|
ポリスチレン製容器中で
飼育した実験区 |
対照区
|
| 平均(匹) | 3.167 | 3.833 |
| 分散 | 2.967 | 0.967 |
| 観測数 | 6 | 6 |
| 自由度 | 5 | 5 |
| 観測された分散比 | 3.069 | |
| P(F<=f) 両側 | 0.122 | |
| F 境界値 両側 | 5.050 | |
分散比が1以上の場合、分散比がF境界値両側以上ならば、帰無仮説は棄却される。
Table.5では、観測された分散比3.069はF境界値両側5.050以内なので、帰無仮説は受容される。よって、信頼度95%で、等分散である。
つぎに、Excelでt検定(等分散を仮定した2標本による検定)をおこなった。t検定では、仮説平均との差異を0、有意水準αを0.05として、両側検定をおこなった。仮説平均との差異0と設定したので、
帰無仮説:対照区の母平均と実験区の母平均は等しい
対立仮説:対照区の母平均と実験区の母平均は等しくない
として、t検定はおこなわれた。Table.6はt検定の結果である。
Table.6 ポリスチレン製容器中で飼育した実験区と対照区のt検定の結果(Excel)
| t検定: 等分散を仮定した2標本による検定 |
|
対照区
|
ポリスチレン製容器中で
飼育した実験区 |
| 平均(匹) | 3.833 | 3.167 |
| 分散 | 0.967 | 2.967 |
| 観測数 | 6 | 6 |
| プールされた分散 | 1.967 | |
| 仮説平均との差異 | 0 | |
| 自由度 | 10 | |
| t | 0.823 | |
| P(T<=t) 片側 | 0.215 | |
| t 境界値 片側 | 1.812 | |
| P(T<=t) 両側 | 0.429 | |
| t 境界値 両側 | 2.228 | |
t値がt境界値両側以上ならば、帰無仮説は棄却される。 t値0.823はt境界値両側2.228以内なので、帰無仮説は受容され信頼度95%で2つの標本の母平均には有意な差がないといえる。
つまり、ポリスチレン製容器中で飼育した実験区と対照区の個体数の増加、つまり分裂頻度には差がないといえる。
実験の結果を整理してみるとFig.6のようになる。
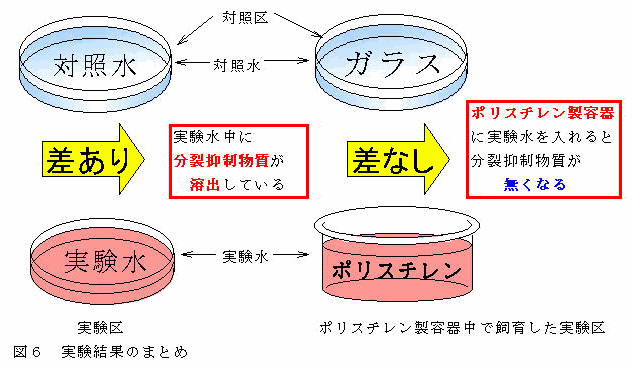
Fig.6 実験結果のまとめ
対照区と実験区のプラナリアの分裂頻度に差が生じた理由について考えてみた。
可能性1,油分の影響
ポリスチレン製容器として用いたカップラーメン容器には、油分の影響を取り除くためノンフライ麺の製品を使用した。また、冷却後、20℃で保管時、使用時に水の状態を十分に観察していたが油分の存在は認められなかった。しかも、実験区とポリスチレン製容器中で飼育した実験区では同じ水(実験水)を使用していた。しかし、対照区とポリスチレン製容器中で飼育した実験区のプラナリアの分裂頻度には差が生じなかった。したがって、油分が実験水に溶出しているため分裂頻度に差が生じたとはいえない。
可能性2,麺等カップラーメン内容物残留の影響
実験水をつくるためのポリスチレン製容器として使用したカップラーメン容器は、スープ別包装の製品かつ未使用のものである。また、冷却後、20℃で保管時、使用時に水の状態を十分に観察していたが異物の存在は認められなかった。しかも、実験区とポリスチレン製容器中で飼育した実験区では同じ水(実験水)を使用していた。しかし、対照区とポリスチレン製容器中で飼育した実験区のプラナリアの分裂頻度には差が生じなかった。したがって、カップラーメンの内容物が実験水に溶出しているため分裂頻度に差が生じたとはいえない。
Table.7は、実験水と対照水のpH測定、導電率測定の結果である。pH測定値、導電率測定値の比較から、塩分等のイオン性物質の特異な溶出は認められなかった。使用したpHメーターはtwinpH B-212(堀場製作所)、使用した導電率計はTwin Cond B-173(堀場製作所)である。
Table.7 対照水と実験水のpHと導電率測定
| | 対照水 | 実験水 |
| pH | 8.2~8.3 | 8.3~8.5 |
| 導電率 | 20~22mS/cm | 20~23mS/cm |
可能性3,スチレンモノマーの影響
ポリスチレンは、一般に、エチレンモノマーとベンゼンからエチルベンゼンを介して得られたスチレンモノマーを重合させたポリマー(プラスチック)である。したがって、製品にはこれら揮発性原料などが残留している可能性がある。そこで、食品衛生法に基づく規格基準では材質中の揮発性物質の規制をおこなっている。熱水を用いる発砲ポリスチレンは残留物の濃度が2000ppm以下かつスチレン及びエチルベンゼンの濃度がそれぞれ1000 ppm以下と定められている。また、ポリスチレンの一般的な材質中に、製法により異なるが、スチレンモノマーが400~1000ppm、スチレンダイマーが400~1000ppm、スチレントリマーが2500~8000ppm程度存在するという報告もある19)。ただし、これらはポリスチレン製容器内の残留物であって、熱水への溶出については、スチレンモノマー以外に問題となるような有機化合物が溶出しているという報告はない。スチレンモノマーの熱水への溶出については次のような報告がある。カップラーメン容器29品について室温の水を入れ30分放置後で不検出(検出限界10ppb)~120ppb20)、食品用ポリスチレン製容器214品に熱水を入れ30分放置後で最高44ppb21)、カップラーメン容器に沸騰水200mlを加え、アルミはくでふたをし、5分後で1~33ppb22)の溶出が報告されている。したがって、熱水にはスチレンモノマーが溶出していると考えられる。分裂頻度の差を生じさせているのはスチレンモノマーなのだろうか。
対照区と実験区の分裂頻度に差が生じたということは、飼育水の違いである。しかし、実験区とポリスチレン製容器中で飼育した実験区では同じ水(実験水)を使用していたが、対照区とポリスチレン製容器中で飼育した実験区のプラナリアの分裂頻度には差が生じなかった。これは、飼育した容器の違いである。つまり、ポリスチレン製容器が実験水から分裂抑制物質を取り除いたことになる。
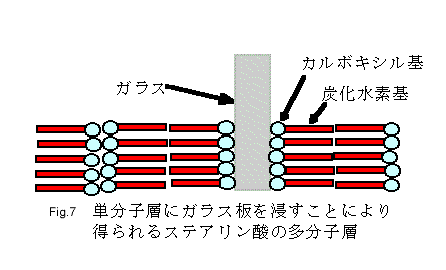
一般に、固体への吸着は温度、吸着する物質(この場合スチレンモノマー)の性質、吸着媒(この場合ガラス、ポリスチレン)の性質および状態などに関係し、物理吸着においては温度の増加は吸着量を大きく減少させる23)。また、次のLangmuirとBlodgettによって考案された実験(Fig.7)によって炭化水素・ガラス間の吸着性と炭化水素・炭化水素間の吸着性を比較説明できる。ステアリン酸は疎水性の炭化水素基と親水性のカルボキシル基からなる高級脂肪酸である。水面のステアリン酸単層最密充てん膜にガラス板を通して浸して上げると、ステアリン酸分子はその極性をガラスの方に向けて付着してくる。このガラス板を再び押し込むと、水の表面に出ている炭化水素鎖がガラス板状の炭化水素とくっつくようになる23)。これは、炭化水素・ガラス間の吸着性よりも炭化水素・炭化水素間の吸着性の方が高いことを示している。したがって、炭化水素であるスチレンモノマーとポリスチレンとの吸着性はガラスよりも高いといえる。
炭化水素を水に溶かすと、その分子のまわりの水のエントロピーが減少する。自然の変化は全エントロピーが増加する方向に進む。もし、炭化水素を適当な方法で十分に多量に溶かすことができるとすれば、エントロピーの減少も大きくなる。この状態は不安定で好ましいことではない。炭化水素に接している水分子よりも、純水の方がエントロピーが大きいので、結局、炭化水素分子がばらばらになって水の中に溶けているよりも、何個か集まった方がエントロピー的に都合がよい、つまりこの方が安定な状態である24)。したがって、高温のため吸着量を減少させたスチレンモノマーは水に溶け出すが、高温のままガラス製容器中で冷却した実験水は20℃まで水温が低下することにより水中での不安定さを増大させる(Fig.8)。このため、この不安定な水溶液(実験水)をポリスチレン製容器に入れた場合、エントロピーが増大する方向であるポリスチレン製容器への物理吸着へと進む。
したがって、Fig.9に示すように、ガラス製シャーレ中の実験水には溶出したスチレンモノマーが不安定ながらも存在し続ける。ポリスチレン製容器中の実験水に溶出したスチレンモノマーはその不安定さを解消するため、ポリスチレン製容器へ物理吸着する。その結果、ポリスチレン製容器中のスチレンモノマーの濃度は時間とともに減少していくと考えられる。
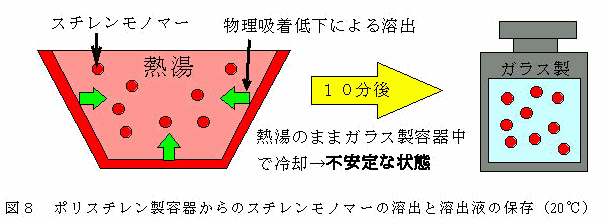
Fig.8 ポリスチレン製容器からのスチレンモノマーの溶出と溶出液の保存(20℃)
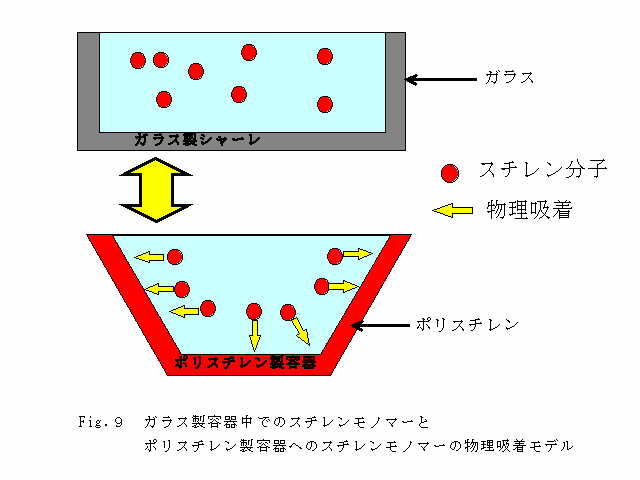
Fig.9 ガラス製容器中でのスチレンモノマーと
ポリスチレン製容器へのスチレンモノマーの物理吸着モデル
容器の材質の違い、つまりガラスとポリスチレンへの吸着性の違いから、スチレンモノマーがポリスチレン製容器に吸着したため、ポリスチレン製容器中で飼育したプラナリアは正常な分裂頻度になったと考えられる。また、物理吸着においては、吸着質と吸着媒の表面が分子間力だけで吸着する。このため、吸着質に吸着質が吸着する多層吸着が可能であり、吸着質と吸着媒が同種の場合、広範囲にわたって多層吸着が可能となる。したがって、59日もの長期にわたっての物理吸着が可能となった。このことからも再吸着された分裂抑制物質がスチレンモノマーだと考えられる。
3.4 実験1の結論
①ポリスチレン製容器から溶出した物質はプラナリアの分裂頻度を抑制する。
②ポリスチレンとガラスへの物理吸着性の違いから、プラナリアの分裂抑制物質はスチレンの可能性がある。